0 |
|---|

НОВОСТИ
27.09.2010 Наш сайт сменил дизайн
Надеемся он стал более удобным для Вас
04.12.2006 Изменение телефонов
ВНИМАНИЕ! С 25 по 29 декабря 2006 года наши телефоны изменятся на (846) 332-65-65, 332-65-64, 332-65-80
19.10.2006 Доступны некоторые ГОСТы
В разделе Справочник размещена подборка из некоторых ГОСТов имеющих отношение к металлопрокату и сварке.
О коррозии металлов
Термин коррозия происходит от латинского "corrosio", что означает разъедать, разрушать. Этот термин характеризует как процесс разрушения, так и результат. Среда, в которой металл подвергается коррозии, называется коррозионной или агрессивной средой. В случае с металлами, говоря об их коррозии, имеют в виду нежелательный процесс взаимодействия металла со средой. Физико-химической сущностью изменений, которые претерпевает металл при коррозии, является окисление металла. Причиной коррозии служит термодинамическая неустойчивость металлов к воздействию веществ, находящихся в контактирующей с ними среде. Пример — кислородная коррозия железа в воде: 4Fe + 2Н2О + ЗО2 = 2(Fe2O3•Н2О). В повседневной жизни для сплавов железа (сталей) чаще используют термин "ржавление".
Классификация коррозионных процессов
Коррозионные процессы отличаются широким распространением и разнообразием условий и сред, в которых они протекают. Поэтому пока нет единой и всеобъемлющей классификации встречающихся случаев коррозии.
Главная классификация производится по механизму протекания процесса. Различают два вида:
Химическая коррозия - это взаимодействие металлов с коррозионной средой, при котором окисление металла и восстановление окислительных компонентов коррозионной среды протекают в одном акте. Так протекает окисление большинства металлов в газовых средах содержащих окислитель (например, окисление в воздухе при повышении температуры).
Электрохимическая коррозия - это взаимодействие металла с коррозионной средой, при котором ионизация атомов металла и восстановление окислительной компоненты среды происходит не водном акте, и их скорости зависят от электродного потенциала металла. По такому процессу протекают, например, взаимодействие металла с кислотами.
По типу агрессивных сред, в которых протекает процесс разрушения, коррозия может быть следующих видов:
- Газовая коррозия;
- Атмосферная коррозия;
- Коррозия в неэлектролитах;
- Коррозия в электролитах
- Подземная коррозия;
- Биокоррозия;
- Коррозия блуждающим током.

По условиям протекания коррозионного процесса различаются следующие виды:

- Контактная коррозия;
- Щелевая коррозия;
- Коррозия при неполном погружении;
- Коррозия при полном погружении;
- Коррозия при переменном погружении;
- Коррозия при трении;
- Коррозия под напряжением.
По характеру разрушения:
- Сплошная коррозия, охватывающая всю поверхность:
- равномерная;
- неравномерная;
- избирательная.
- Локальная (местная) коррозия, охватывающая отдельные участки:
- пятнами;
- язвенная;
- точечная (или питтинговая);
- сквозная;
- межкристаллитная.

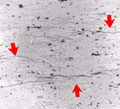
Показатели скорости коррозии
Для установления скорости коррозии металла в данной среде обычно ведут наблюдения за изменением во времени какой-либо характеристики, объективно отражающей изменение свойства металла. Чаще всего в коррозионной практике используют следующие показатели.
Показатель изменения массы - изменение массы образца в результате коррозии отнесенный к единице поверхности металла S и к единице времени (например, г/м ч) в зависимости от условий коррозии различают:
- а) отрицательный показатель изменения массы
- б) положительный показатель изменения массы

Объемный показатель коррозии.
Применительно к электрохимической коррозии когда процесс катодной деполяризации осуществляется за счет разряда ионов водорода, например, по схеме 2Н + 2е = Н, или ионизация молекул кислорода О + 4е +2НО = 4ОН; вводятся соответственно кислородный (К) и водородный (К) показатель соответственно.
Водородный показатель коррозии - это объем выделившегося Н в процессе коррозии, отнесенный к Su .
Кислородный показатель коррозии - это объем поглощенного в процессе О, отнесенный к Su .
Показатель сопротивления.
Изменение электрического сопротивления образца металла за определенное время испытаний также может быть использован в качестве показания коррозии (К).
КR = ( R/Ro)100% за время t
где Ro и R электрическое сопротивление образца соответственно до и после коррозии.
У этого способа есть некоторый недостаток толщина металла во все время испытаний должна быть одинаковой и по этой причине чаще всего определяют удельное сопротивление, т.е. изменение электрического сопротивления на единицу площади образца (см, мм) при длине равной единице. Этот метод имеет ограничения применения (для листового металла не более 3мм). Наиболее точные данные получают для проволочных образцов. Этот метод не пригоден для сварных соединений.
Механический показатель коррозии.
Изменение какого-либо свойства металла за время коррозии . Сравнительно часто пользуются изменением предела прочности. Глубина коррозионного разрушения может быть средней или максимальной. Глубинный показатель коррозии можно использовать для характеристики как равномерной, так и неравномерной коррозии (в том числе и местной) металлов. Он удобен для сравнения скорости коррозии металла с различными плотностями. Переход от массового, токового и объемного к глубинному возможен при равномерной коррозии.
Электрохимическая коррозия

Электрохимическая коррозия является наиболее распространенным типом коррозии металлов. По электрохимическому механизму коррозируют металлы в контакте с растворами электролитов (морская вода, растворы кислот, щелочей, солей). В обычных атмосферных условиях и в земле металлы коррозируют также по электрохимическому механизму, т.к. на их поверхности имеются капли влаги с растворенными компонентами воздуха и земли. Электрохимическая коррозия является гетерогенным и многостадийным процессом. Ее причиной является термодинамическая неустойчивость металлов в данной коррозионной среде.
Термодинамика электрохимической коррозии металлов.
Стремлением металлов переходить из металлического в ионное состояние для различных металлов различно. Вероятность такого перехода зависит также от природы коррозионной среды. Такую вероятность можно выразить уменьшением свободной энергии при протекании реакции перехода в заданной среде при определенных условиях.
Следовательно, для электрохимического растворения металла необходимо присутствие в растворе окислителя (деполяризатора, который бы осуществлял катодную реакцию ассимиляции электронов), обратимый окислительно-восстановительный потенциал которого положительнее обратимого потенциала металла в данных условиях. Катодные процессы при электрохимической коррозии могут осуществляться различными веществами: ионами, молекулами
оксидами и гидроксидами (как правило, малорастворимыми продуктами коррозии, образованными на поверхности металлов), органическими соединениями. В коррозионной практике в качестве окислителей-деполяризаторов, осуществляющих коррозию, выступают ионы водорода и молекулы растворенного в электролите кислорода. При увеличении активности ионов металла (повышение концентрации ионов металла в растворе), потенциал анода возрастает, что приводит к торможению растворения металла. Понижение активности металла, напротив, способствует растворению металла. В ходе коррозионного процесса изменяются не только свойства металлической поверхности, но и контактирующего раствора (изменение концентрации отдельных его компонентов). При уменьшении, например, концентрации деполяризатора, у катодной зоны может оказаться, что катодная реакция деполяризации термодинамически невозможна.
Гомогенные и гетерогенные пути электрохимической коррозии.
Причину коррозии металлов в растворах, не содержащих одноименных ионов, объясняет теория необратимых потенциалов. Эта теория рассматривает поверхность металлов как однородную, гомогенную. Основной и единственной причиной растворения (коррозии) таких металлов является термодинамическая возможность протекания анодного и катодного актов. Скорость растворения (коррозии) будет определяться кинетическими факторами. Но гомогенную поверхность металлов можно рассматривать как предельный случай, который может быть реализован, например, в жидких металлах. (ртуть и амальгамы металлов). Для твердых металлов такое допущение будет ошибочным, хотя бы потому, что различные атомы сплава (и чистого металла) занимают различное положение в кристаллической решетке. Наиболее сильное отклонение от гомогенной конструкции будет наблюдаться при наличии в металле инородных включений, интерметаллидов, границ зерен и т.д. В этом случае, разумеется, поверхность является гетерогенной. Установлено, что даже при наличии на поверхности металла неоднородностей в целом поверхность остается эквипотенциальной. Таким образом, неоднородность поверхностей сплава не может являться основной причиной общей коррозии металла. Наиболее существенной в подобных случаях является ионизация растворения анодной составляющей вблизи катодной составляющей. Это возможно, если на поверхности металлической конструкции возникают гальванические элементы, а именно в случаях, когда наблюдается:
- а) неоднородность металлической фазы, обусловленная неоднородностью сплава, а также в результате микро и макровключений.
- б) неоднородность поверхности металла, как следствие наличия границ блоков и зерен кристаллов, выходов дислокаций на поверхность, анизотропности кристаллов.
- в) неоднородность защитных пленок на поверхности за счет микро и макропор пленки или за счет неравномерного образования на поверхности вторичных продуктов коррозии.
Выше рассмотрены два крайних механизма саморастворения металлов: равномерное растворение идеально гомогенной поверхности и растворения (в основном локальное) микроэлементов при пространственном разделении катодных и анодных зон (процессов). В общем случае, необходимо считаться с возможностью протекания на анодных участках наряду с основными анодными процессами катодных процессов, на катодных же участках могут протекать с пониженной скоростью анодные процессы растворения.
Можно сделать вывод, что нет оснований противопоставлять "гомогенный" и "гетерогенный" пути протекания коррозионных процессов. Правильнее будет их рассматривать как факторы, взаимно дополняющие друг друга. Основной же причиной коррозии металлов остается по-прежнему термодинамическая вероятность протекания в данных условиях на металле анодных процессов ионизации металла и сопряженного с ним катодного процесса деполяризации.
Анодные процессы при электрохимической коррозии металлов.
Для протекания коррозионного процесса существенным является состояние форма соединения, в котором находится катион металла в растворе. Ионизация металла с последующим переходом в раствор простых компонентов металла представляет лишь одно из возможных направлений анодных процессов. Форма их конкретного состояния во многом определяется как природой металла и контактирующей с ним средой, так и направлением и величиной поляризующего тока (или электродного потенциала). Переходя в раствор, коррозирующий металл вступает в связь либо с растворителем, либо с компонентами раствора. При этом могут образовываться простые и комплексные соединения с различной растворимостью и с различной адгезией к поверхности металла. При высоких положительных значениях потенциала на аноде возможен процесс окисления воды с выделением кислорода. В зависимости от того, какие процессы или их сочетания протекают на аноде, они могут в значительной мере (а иногда и полностью) контролировать суммарный процесс коррозии.
Простейшими анодными реакциями являются такие, в результате которых образуются растворимые гидратированные и комплексные катионы, которые отводятся от анода путем диффузии, миграции (перенос за счет электрического поля) или конвекции. Полярные молекулы жидкости электростатически взаимодействуют с заряженными ионами, образуют сольватные (в случае воды-гидратные) комплексы, обладающие значительно меньшим запасом энергии чем ионы в кристаллической решетке металла. Причиной перехода атомов металла с поверхности и их ионизация является электростатическое взаимодействие (сольватация) ионов металла с полярными молекулами растворителя.